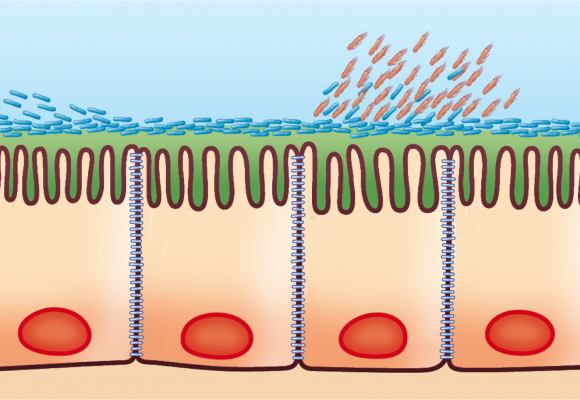
Estudios recientes con Saccharomyces boulardii sugieren que podría tener un papel relevante en el futuro abordaje de patologías tan importantes como la obesidad o el síndrome metabólico gracias a sus efectos a nivel de restitución de la función barrera intestinal y reducción de distintos marcadores de inflamación sistémica. En este artículo, el Dr. Guarner revisa brevemente algunos de los trabajos que sustentan esta nueva línea de investigación.
El fallo de la función barrera de la mucosa del tracto intestinal (leaky gut) ha sido reconocido desde hace años en el contexto del paciente crítico de cuidados intensivos1. La translocación de bacterias viables o de sus productos desde la luz del tracto digestivo al medio interno se considera que es un factor precipitante o agravante en procesos agudos tales como el shock, el distrés respiratorio, el síndrome de respuesta inflamatoria sistémica y el fallo multiorgánico. También es un mecanismo fisiopatológico perfectamente reconocido en las complicaciones de las hepatopatías descompensadas (ascitis, peritonitis bacteriana, encefalopatía hepática, etc.). Pero fuera de este contexto concreto, el término leaky gut se ha empleado mayoritariamente en medicinas alternativas. El leaky gut syndrome sería un defecto primario en el origen de diferentes dolencias o trastornos de tipo fatiga, mialgias, envejecimiento prematuro, intolerancias alimenticias, estrés, autismo, etc. Dado su carácter especulativo como proposición teórica sin comprobación y soporte empírico, la medicina basada en la evidencia ha prestado poca atención a este concepto.
Pero el panorama ha cambiado completamente en años recientes2. Pienso que el punto de inflexión vino de la mano de experimentos de Patrice Cani y colaboradores en Bruselas3. Observaron que las dietas hiperlipidémicas que se utilizan para inducir obesidad y síndrome metabólico en ratones (esteatosis hepática, resistencia a la insulina, dislipemia) generaban una discreta elevación de los niveles plasmáticos de endotoxina bacteriana (LPS), lo que denominaron metabolic endotoxemia, con niveles muy inferiores a los del de shock séptico. A continuación decidieron someter a ratones con dieta normal (no hiperlipidémica) a inyección subcutánea continua de endotoxina a pequeñas dosis para reproducir la ‘endotoxemia metabólica’ descrita en los experimentos con dieta hiperlipidémica. El resultado fue claro: en el plazo de cuatro semanas los ratones desarrollaron hiperglicemia, resistencia a la insulina, esteatosis hepática y obesidad. En este modelo experimental, la translocación de productos bacterianos parece ser el medidor de un estado de inflamación de bajo grado que conduce al síndrome metabólico. El impacto de este estudio ha sido enorme. Por ejemplo, la administración oral de emulsificantes (carboximetilcelulosa o polisorbato 80) altera la barrera mucosa intestinal, aumenta la permeabilidad e induce síndrome metabólico en ratones normales con una dieta normal4. Dado que en personas con incremento de adiposidad visceral (acumulo de grasa abdominal) se detectan también niveles de endotoxemia, los expertos reconocen que el fallo de la función barrera de la mucosa intestinal es un factor importante en la patogénesis del síndrome metabólico humano5.
Y parece que no solo es relevante para el síndrome metabólico. El Dr. Alessio Fasano, del Massachusetts General Hospital, uno de los más reconocidos expertos en enfermedad celiaca, investiga desde hace unos años el rol del fallo de la barrera intestinal en el origen de las enfermedades de tipo autoinmune6. También se observó experimentalmente que el estrés emocional puede alterar la función barrera, y este defecto se ha identificado en pacientes con depresión post-estrés7.
Queda pendiente saber si el leaky gut es realmente un defecto primario que conduce a distintos trastornos, o más bien es un fenómeno secundario a procesos subyacentes que generan inflamación de la pared intestinal y, por tanto, fallo de la función barrera. Los expertos señalan que faltan evidencias que demuestren que al revertir el defecto de permeabilidad mejora la clínica asociada2. Aquí es donde parece que los probióticos pueden jugar un papel muy relevante.
El Profesor Patrice Cani ha observado en su modelo experimental que el tratamiento con Saccharomyces boulardii reduce el peso corporal, la grasa visceral y subcutánea, y la esteatosis hepática en ratones genéticamente obesos por resistencia a la leptina8. Los cambios en acúmulo de grasa se asocian a un descenso en distintos marcadores de inflamación sistémica, incluyendo niveles de IL-6, IL-4, TNF y IL-1. El efecto antiinflamatorio es más intenso que el efecto sobre los parámetros de obesidad, de modo que se sugiere que sería el mecanismo primario8.
Otra contribución muy importante es el ensayo con S. boulardii en pacientes con VIH recientemente publicado por la Dra. Judith Villar y cols., del Hospital del Mar de Barcelona9. Hay un defecto en la permeabilidad intestinal en pacientes con infección por VIH que permite la translocación de bacterias intestinales y sus productos, generando estimulación periférica de la inmunidad innata. En el ensayo aleatorizado, controlado con placebo, y a doble ciego, los pacientes que recibieron por vía oral el probiótico S. boulardi (300 mg/día) durante 12 semanas experimentaron una reducción significativa de diversos parámetros inflamatorios sistémicos (IL-6, Prot C reactiva, beta2-microglobulina), así como de los niveles circulantes de la proteína fijadora de endotoxina (LPS). El efecto beneficioso se prolongó después del tratamiento y era reconocible hasta 12 semanas después.
Es probable que algunos probióticos puedan revertir fenómenos relacionados con fallo de la función barrera intestinal en el área ileocecal, dónde pueden alcanzar altas concentraciones tras su administración oral. En este sentido, los tratamientos a largo plazo pueden ser más reveladores. ¿Probióticos para prevenir la obesidad? Puede ser, solamente falta investigarlo en serio.
Bibliografía
- Fink MP. Leaky gut hypothesis: a historical perspective. Crit Care Med. 1990; 18(5): 579-80.
- Odenwald MA, Turner JR. Intestinal permeability defects: is it time to treat? Clin Gastroenterol Hepatol. 2013; 11(9): 1075-83.
- Cani PD, Amar J, Iglesias MA et al. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes. 2007; 56(7): 1761-72.
- Chassaing B, Koren O, Goodrich JK, Poole AC, Srinivasan S, Ley RE, Gewirtz AT. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. Nature. 2015; 519(7541): 92-6.
- Tremaroli V, Bäckhed F. Functional interactions between the gut microbiota and host metabolism. Nature. 2012; 489(7415): 242-9.
- Fasano A. Leaky gut and autoimmune diseases. Clin Rev Allergy Immunol. 2012; 42(1): 71-8.
- Kelly JR, Kennedy PJ, Cryan JF, Dinan TG, Clarke G, Hyland NP. Breaking down the barriers: the gut microbiome, intestinal permeability and stress-related psychiatric disorders. Front Cell Neurosci. 2015; 9: 392.
- Everard A, Matamoros S, Geurts L, Delzenne NM, Cani PD. Saccharomyces boulardii administration changes gut microbiota and reduces hepatic steatosis, low-grade inflammation, and fat mass in obese and type 2 diabetic db/db mice. M Bio. 2014; 5(3): e01011-14.
- Villar-García J, Hernández JJ, Güerri-Fernández R et al. Effect of probiotics (Saccharomyces boulardii) on microbial translocation and inflammation in HIV-treated patients: a double-blind, randomized, placebo-controlled trial. J Acquir Immune Defic Syndr. 2015; 68(3): 256-63.