Introducción
El eje microbiota-intestino-cerebro, y su repercusión en la salud y la enfermedad, solo puede entenderse considerando el papel que tienen en el organismo los sistemas homeostáticos, el sistema nervioso, el endocrino y el inmunitario, así como la comunicación bidireccional que establecen entre ellos, tanto a nivel general como en cada órgano, permitiendo una adecuada homeostasis y, consecuentemente, la salud del individuo. En este contexto, en el intestino, en el que estos sistemas homeostáticos se encuentran mostrando una enorme complejidad, la microbiota allí presente va a establecer un estrecho dialogo con ellos, incidiendo así en la homeostasis intestinal. Desde esta localización, a través de diferentes vías (sanguíneas y nerviosas), los mediadores de ese dialogo (metabolitos microbianos, neurotransmisores, hormonas y citoquinas) pueden alcanzar el cerebro y repercutir en su funcionamiento. Dada la bidireccionalidad del eje, todo lo que sucede en el cerebro va a influir en el intestino, modificando su actividad y también a la microbiota residente. Hay que tener presente que los mediadores implicados en esta conexión intestino-cerebro también pueden alcanzar al resto del organismo.
La adecuada comunicación entre todos los componentes del eje, la cual se establece de forma muy temprana tras el nacimiento, va a permitir el mantenimiento de una buena salud a lo largo de toda la vida. Hay muchos factores que pueden incidir en este eje, y permitir, o no, su correcto funcionamiento. Entre estos factores se puede destacar la dieta que se haga, pero también la actividad física, el ambiente en que se viva, las relaciones sociales, las situaciones de estrés, o la medicación que tengamos. En este marco podemos incluir a los probióticos, de los que ya se conocen algunas cepas que pueden ayudar a tener un buen estado del eje que nos ocupa, bien consiguiendo una mejor microbiota intestinal, o bien actuando más directamente sobre el sistema inmunológico (inmunobióticos) o el sistema nervioso (psicobióticos), mejorando su funcionamiento. Al conseguirse unos mejores sistemas homeostáticos, se posibilita el mantenimiento de la salud, y esto conlleva que se pueda alcanzar una mayor longevidad saludable. Este aumento de la esperanza de vida ya ha sido comprobado en animales de experimentación. El mecanismo que permite estos efectos de los que recientemente se han denominado “gerobióticos” parece centrarse en su capacidad de controlar el estrés oxidativo e inflamatorio que subyace en múltiples patologías y en el envejecimiento. Todos estos aspectos aquí mencionados se irán comentando en mayor detalle en los siguientes apartados.
La comunicación entre los sistemas homeostáticos:
la Psiconeuroinmunoendocrinología
El mantenimiento de nuestra salud se basa en tener una adecuada respuesta homeostática. Para conseguir esa homeostasis, ese equilibrio dinámico que permite responder constantemente a los cambios internos y externos a los que nos vemos sometidos, disponemos de unos sistemas fisiológicos, denominados homeostáticos: el nervioso, el endocrino y el inmunitario, los cuales no solo deben funcionar adecuadamente; también tienen que comunicarse de forma apropiada.
La existencia de esta comunicación entre los complejos sistemas fisiológicos que permiten la homeostasis, hoy plenamente asumida en el mundo científico, ha costado que sea aceptada, tanto desde las neurociencias como desde la Inmunología. No obstante, esta comunicación neuroinmunoendocrina ha permitido comprender, desde la perspectiva científica, toda una serie de hechos que continuamente se observan en la vida cotidiana. Así, por ejemplo, se sabe que las situaciones de estrés emocional, tristeza, ansiedad o depresión se suelen acompañar de un peor sistema inmunitario, lo que supone una mayor propensión a padecer desde procesos infecciosos hasta cánceres o enfermedades autoinmunes. Por el contrario, situaciones agradables o una “visión optimista” de la vida ayudan a tener un mejor sistema inmunológico y, en general, a presentar un estado más saludable. En base a la bidireccionalidad de la comunicación, se puede explicar cómo las alteraciones que experimenta el sistema inmunitario, por ejemplo, cuando se tiene un proceso infeccioso, llegan a modificar la funcionalidad del sistema nervioso, pudiéndose, en determinadas situaciones, desarrollar estados depresivos o incluso psicóticos.
Por lo indicado se entiende que a la ciencia que estudia esas interconexiones, la Psiconeuroinmunoendocrinología, se la considere también “la ciencia de la salud”. Esta nueva disciplina (tengamos en cuenta que las primeras aportaciones científicas que iniciaron su constitución provienen de los años setenta del pasado siglo) sigue causando asombro con cada nuevo descubrimiento.
El dialogo entre los sistemas homeostáticos, ya verificado con numerosas investigaciones, puede establecerse gracias a que los mediadores típicos de cada uno de los tres sistemas, los neurotransmisores del sistema nervioso, las hormonas del endocrino y las citoquinas del inmunitario, encuentran receptores en las células de los otros sistemas y actúan sobre ellas. Además, otro hecho curioso es que las células de esos sistemas producen todos los mediadores específicos de los demás. Así, los leucocitos producen neurotransmisores y hormonas, y las células nerviosas y endocrinas pueden producir citoquinas.
La comunicación entre los tres sistemas homeostáticos se establece tanto a nivel general del organismo (mediante lo que se han denominado circuitos largos), como a nivel local (circuitos cortos). Así, cuando se modifica nuestro sistema nervioso o endocrino, por ejemplo, por estímulos psicosensoriales, tenemos no solo los efectos típicos de cambios conductuales, sino que también hay modificaciones a nivel del sistema inmunitario que existe en el cerebro y de la inmunidad sistémica. Por su parte, el sistema inmunitario responde frente a las continuas infecciones y tumores de las que tiene que defendernos generando fundamentalmente citoquinas. Estas moléculas no solo ejercen su típica función defensiva; también llegarán y modificarán el funcionamiento de los sistemas nervioso y endocrino. Como consecuencia de esa comunicación también se afecta el metabolismo general del individuo.
La comunicación neuroinmunoendocrina en el intestino y su repercusión a nivel general del organismo
La comunicación bidireccional neuroinmunoendocrina se establece en todos los órganos, permitiendo el control de la homeostasis en cada uno de ellos. El intestino es una localización en la que los sistemas homeostáticos, el nervioso, el endocrino y el inmunitario, así como sus interrelaciones presentan una enorme complejidad.
El sistema nervioso intestinal es tan completo que se le ha denominado el segundo cerebro. Tenemos un sistema nervioso intrínseco, el entérico (SNE) con sus plexos neuronales y sus células de glía, y un sistema nervioso extrínseco, el sistema nervioso autónomo (SNA), constituido por el simpático y el parasimpático (nervio vago). Gracias a ellos se pueden controlar todas las funciones intestinales, pero además, lo que sucede en el intestino llega al sistema nervioso central (SNC), incidiendo en todos los aspectos de su funcionamiento.
El sistema inmunitario intestinal es la localización inmunitaria más compleja y peculiar de todo el organismo. Este “tejido linfoide asociado al intestino” (GALT) tiene un amplio conjunto de células inmunitarias, constituyentes que llevan a cabo la inducción de la respuesta inmunitaria y otros que realizan el papel efector de la misma. Todo un conjunto de células de la inmunidad innata y adquirida van a ejercer una delicada función de defensa frente a los patógenos que llegan, así como de tolerancia para los antígenos de los alimentos y la microbiota intestinal. También, actualmente, se considera a la compleja barrera epitelial como parte del sistema defensivo de la mucosa intestinal, pues no solo dispone de células típicamente inmunitarias (células M, linfocitos intraepiteliales, etc.); también los otros componentes (enterocitos, células de Paneth, etc.) pueden participar en esa función defensiva. Los mediadores que generan todas esas células inmunitarias van a actuar a nivel intestinal, pero también a nivel sistémico y llegar al cerebro, utilizando la vía nerviosa y la sanguínea.
El intestino también dispone de un potente sistema endocrino, con células, como las enteroendocrinas, productoras de hormonas que van a controlar múltiples procesos digestivos. Estas hormonas, por tanto, van a actuar a nivel intestinal y también general del organismo.
Esos tres sistemas homeostáticos van a poder comunicarse, lo que hacen en localizaciones estratégicas del intestino, que permiten su adecuada homeostasis. Además, los mediadores de esos sistemas y los generados tras su comunicación van a poder llegar al resto del organismo y al SNC.
Interacción de la microbiota con los sistemas homeostáticos en el intestino y su repercusión en el cerebro
En la comunicación neuroinmunoendocrina intestinal que se va a proyectar al SNC hay que introducir un nuevo elemento: la microbiota intestinal, la cual va a “dialogar” con los tres sistemas homeostáticos.
Interacción de la microbiota y el sistema inmunitario
La comunicación entre la microbiota intestinal y las células de la inmunidad innata y adquirida de esa mucosa es compleja y se establece mediante diversas vías, entre las que siempre está presente una bidireccionalidad, y en la que participan también los componentes de la barrera epitelial y de la capa de moco.
Esa comunicación puede ser directa, pero con mayor frecuencia es indirecta. Se realiza a través de los numerosos metabolitos y las microvesículas que genera la microbiota. Todo ello, directamente o mediante la estimulación de otras células (como las epiteliales), puede llegar a las células inmunitarias de intestino. Dado el paso de estas células a la sangre que riega la mucosa del intestino y su conexión con el resto del cuerpo, la microbiota intestinal no solo va a condicionar el sistema inmunitario de las mucosas, sino también el sistémico. Además, estos metabolitos pueden llegar a la médula ósea y participar en la hematopoyesis, regulando la diferenciación, supervivencia y actividad de las células del sistema inmunitario que van a recircular por el organismo.
Las células de la inmunidad innata y las de la adquirida van a ser afectadas por la microbiota en su desarrollo y posteriormente en el número de cada uno de sus componentes y en la capacidad funcional de los mismos. De hecho, en animales de experimentación libres de gérmenes se ha comprobado que la falta de microbiota hace que esos animales tengan un sistema inmunitario deficiente. También la presencia de disbiosis supone una alteración inmunológica que subyace en numerosas patologías.
A pesar de los avances científicos, todavía no se conoce totalmente cómo el sistema inmunitario, que se encarga de reconocer lo extraño y eliminarlo, puede respetar a los componentes de la microbiota autóctona y no a otros microorganismos que, perteneciendo incluso al mismo género que los constituyentes de la misma, son potencialmente patógenos. Uno de los mecanismos es la capacidad de la microbiota de influir en el control de la respuesta de oxidación e inflamación que genera el sistema inmunitario para destruir a los patógenos. De hecho, se sabe que muchos de los microorganismos de la microbiota intestinal tienen propiedades antioxidantes y antiinflamatorias, gracias a los mediadores que producen y al aumento de ese tipo de compuestos que generan en otras células.
En la respuesta de tolerancia a la microbiota autóctona participa la respuesta inmunitaria innata, la cual inicia la respuesta y regula el funcionamiento de tolerancia que es llevado a cabo por parte de la respuesta inmunitaria adquirida o adaptativa. Un aspecto importante de esta tolerancia se basa en el hecho de que, tras el reconocimiento de los microorganismos autóctonos por las células de la inmunidad intestinal, las subpoblaciones de células T secretan determinadas citoquinas que permiten una modulación del equilibrio entre inflamación y antiinflamación. Así, el balance Th17/Treg se deriva a favor de las Treg, esto es, de la antiinflamación, ya que los Treg, cuya presencia en la mucosa intestinal es más relevante que en otras localizaciones, producen citoquinas antiinflamatorias, como la IL-10, que controlan la inflamación y permiten la tolerancia. De hecho, se ha comprobado que los metabolitos de la microbiota, como los ácidos grasos de cadena corta (AGCC), especialmente el butirato, pueden expandir a esas células, al hacer que las de la inmunidad innata ayuden en esa red de regulación y permitan el control de la inflamación. Además, la microbiota hace que esas células inmunitarias se reprogramen epigenéticamente y metabólicamente, adquiriendo de esta manera características de “memoria” que les permiten aumentar su posterior capacidad de respuesta.
Con todo ello, se puede entender cómo unos adecuados microorganismos intestinales van a favorecer tanto la tolerancia a los mismos, al enseñar a las células inmunitarias a modular su respuesta inflamatoria, como el refuerzo y la ampliación de la adquisición de una potente respuesta protectora y defensiva frente a los patógenos en todo el organismo. Este aprendizaje inmunitario, paralelo al desarrollo ontogénico del sistema defensivo, en el que participa de forma relevante la microbiota, se lleva a cabo de forma muy temprana, en los primeros años de nuestra vida. Este periodo es fundamental y representa una ventana crítica de susceptibilidad para la salud o las enfermedades que se tendrán a lo largo de la vida. De hecho, se sabe que en la vida neonatal el sistema inmunitario presenta una baja capacidad de producir citoquinas proinflamatorias, teniendo un sesgo a respuestas reguladoras, lo que es favorecido por la microbiota. Por ello, una microbiota adecuada se asocia con una mejor inmunidad y, consecuentemente, con una mejor salud, mientras que un estado de disbiosis se relaciona con una inadecuada inmunidad y con la presencia de patologías.
Interacción de la microbiota y el sistema nervioso
La microbiota determina el adecuado desarrollo y funcionamiento del SNE, afectando no solo a las neuronas, sino también a las células gliales entéricas, como se ha podido observar en animales de experimentación libres de gérmenes. Los microrganismos intestinales producen toda una serie de neurotransmisores, como GABA, serotonina, dopamina, norepinefrina y acetilcolina, entre otros, así como de neuropéptidos. Estos mediadores pueden actuar en el SNE, pero también llegar al SNC por vía sanguínea o a través del nervio vago. De esta manera, los mediadores de la microbiota pueden alcanzar el cerebro y modificar el desarrollo y actividad de sus células, tanto de las neuronas como de la glía y, consecuentemente, inciden en el funcionamiento cerebral. Además de los neurotransmisores microbianos, muchas células presentes en la mucosa intestinal producen mediadores nerviosos, como lo hacen las células de SNE y también las células inmunitarias y de la barrera epitelial. Todas esas células pueden ser modificadas en esta capacidad de producción de neurotransmisores por la presencia de los diversos mediadores de la microbiota, y pueden llegar, fundamentalmente vía nervio vago, al SNC.
Interacción de la microbiota y el sistema endocrino
La microbiota intestinal también produce mediadores típicos del sistema endocrino, como hormonas, los cuales van a llegar a las células de la mucosa intestinal y modificarlas. Estas hormonas microbianas y las generadas en las células intestinales (inmunitarias y enteroendocrinas) pueden alcanzar, por vía sanguínea, el cerebro, pero también otras localizaciones corporales.
El eje microbiota-intestino-cerebro
Por lo indicado, es evidente que el eje microbiota-intestino-cerebro supone un complejo sistema de interconexiones multidireccionales que permite que todos los mediadores generados por la microbiota y en su diálogo con los sistemas homeostáticos intestinales (múltiples metabolitos, neurotransmisores, hormonas, y citoquinas) puedan alcanzar el cerebro. El eje utiliza diferentes vías, la humoral (mediante la circulación intestinal, sistémica y la barrera hematoencefálica) y la neural (fundamentalmente vía nervio vago). Posiblemente, un aspecto de los mejor estudiados de esta comunicación es la de unos de los metabolitos de la microbiota intestinal, los AGCC, que atraviesan la barrera hematoencefálica y modifican la producción de factores generados por las células nerviosas, tanto neuronas como gliales. Por ejemplo, se ha comprobado que el butirato, al incidir en la expresión del factor neurotrófico derivado del cerebro (BDNF) en el hipocampo, altera la activación del mismo en respuesta a estímulos emocionales.
Dado que todas esas comunicaciones son bidireccionales, hay que tener presente que los procesos cerebrales, y los mediadores que con ellos se generan en el SNC, van a llegar a los sistemas homeostáticos intestinales, empelando tanto la vía nerviosa (mediante el sistema nervioso autónomo, el simpático y especialmente el nervio vago) como los ejes neuroendocrinos (como el del hipotálamo-hipófisis-adrenal, HHA), modificando el diálogo de estos sistemas y el que ellos establecen con la microbiota. Esta dirección del eje, cerebro-intestino-microbiota, explica hechos como que la respuesta inadecuada a situaciones de estrés, los estados emocionales y un largo etcétera, repercutan en el estado funcional del intestino y en toda la comunicación entre microorganismos y sistemas homeostáticos, y finalmente en la microbiota. Un hecho a tener en cuenta es que los mediadores implicados en este eje no solo van a implicar las localizaciones iniciales y finales del mismo, esto es, el intestino y el cerebro, sino que también van a poder afectar a todos los demás tejidos y sistemas, influyendo de este modo en su funcionamiento y en el metabolismo corporal.
En la figura 1 se resume la interacción de la microbiota con los diferentes sistemas homeostáticos en el intestino y su repercusión en el cerebro a través del eje microbiota-intestino-cerebro. Así, la microbiota intestinal ha surgido como un regulador clave de la señalización del eje intestino-cerebro, con importantes implicaciones para la Neurogastroenterología de esta vía bidireccional que es facilitada por vías neuronales, endocrinas, metabólicas e inmunológicas. Como bien señalan Wilmes et al. (2021), los estudios han demostrado que la composición y funciones de la microbiota pueden cambiar en los trastornos psiquiátricos relacionados con el estrés. Asimismo, las alteraciones de la microbiota intestinal son también una característica del síndrome del intestino irritable (SII), un trastorno del eje intestino-cerebro que comparte altos niveles de comorbilidad psiquiátrica, incluyendo síntomas tanto de ansiedad como de depresión, aunque todavía no está claro cómo esta disbiosis que aparece en esta patología funcional puede alinearse con los síntomas principales de estas comorbilidades psiquiátricas. Un ejemplo de ello es el ensayo realizado por Constante et al. (2020) en ratones colonizados con microbiota de pacientes con SII y ansiedad comórbida, en los que el tratamiento con Saccharomyces boulardii CNCM I-745 mejora la motilidad gastrointestinal y el comportamiento de ansiedad.
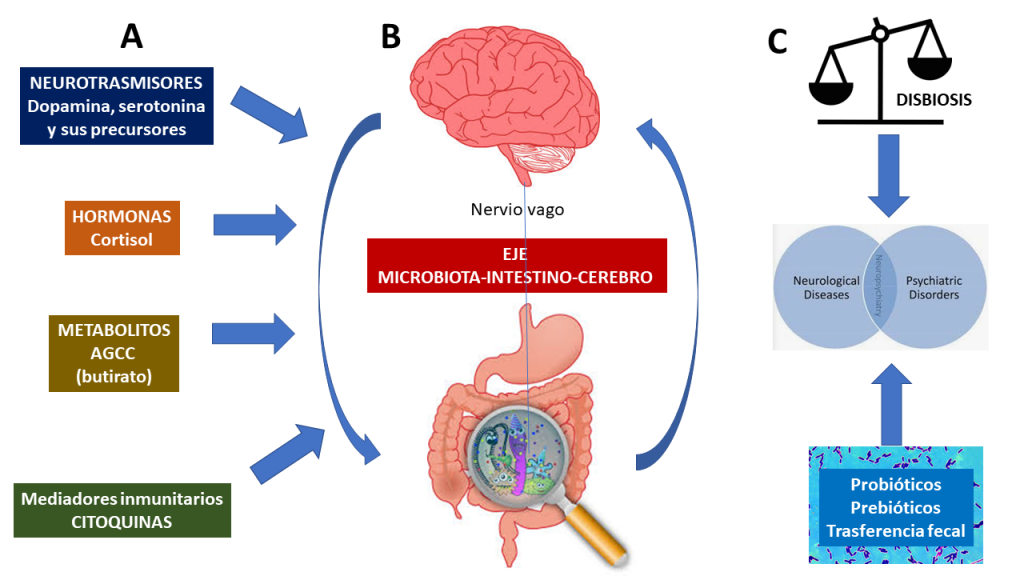
Figura 1. Eje microbiota-intestino-cerebro
- El tracto gastrointestinal humano contiene una red nerviosa muy compleja, denominada sistema nervioso entérico, cuyo objetivo principal es la regulación de las funciones fisiológicas y la modulación de la comunicación entre el intestino y el sistema nervioso central, tanto en sentido ascendente (intestino-cerebro) como descendente (cerebro-intestino). Este sistema de comunicación se conoce como el eje microbiota-intestino-cerebro.
- Existen múltiples vías directas e indirectas que mantienen una intensa interacción bidireccional entre el intestino y el sistema nervioso central y que involucran los sistemas endocrinológico, inmunitario, neurológico y metabólico. La comunicación se realiza, principalmente, a través del nervio vago y también de múltiples terminaciones nerviosas intestinales del sistema nervioso periférico.
- Las alteraciones en el eje microbiota-intestino-cerebro suelen estar asociadas a ciertas patologías psiquiátricas (desde la ansiedad y la depresión hasta el autismo) e intestinales (síndrome de intestino irritable) y a la presencia de una microbiota aberrante en los individuos que las padecen por lo que se puede modular con el empleo de cepas probióticas específicas, sustratos prebióticos o trasferencia de microbiota fecal.
Como se ha comentado anteriormente sobre el momento en el que se establecen los diálogos entre la microbiota y los sistemas homeostáticos, también para el establecimiento del eje microbiota-intestino-cerebro se ha sugerido que existen “periodos sensibles” o “ventanas críticas” en su consolidación, generalmente tempranas, las cuales van a condicionar el buen funcionamiento del eje a lo largo de la vida del individuo. Los primeros momentos de la vida son cruciales para el establecimiento de unos diálogos apropiados entre microbiota y sistemas homeostáticos, pero todo el periodo de crecimiento, y especialmente la adolescencia, resultan fundamentales para terminar de constituir el eje microbiota-intestino-cerebro, característico del adulto. El cómo sea el mismo en ese momento en el que se inicia el largo proceso del envejecimiento, va a ir determinando como se haga dicho proceso.
Eje microbiota-intestino-cerebro y su repercusión en la conducta individual y social
Por todo lo comentado anteriormente, es entendible que la microbiota intestinal, al poder modificar el funcionamiento cerebral, pueda incidir en la manifestación más evidente del mismo, las respuestas conductuales que tenga cada individuo. De hecho, tras la modificación de esa microbiota se han observado múltiples cambios en la conducta, tanto a nivel individual (en la conducta alimentaria, de adiciones, entre otras) como social (llegándose a sugerir su participación en la elección de las personas con las que nos relacionamos y en la de la pareja). Como siempre, existe una bidireccionalidad; no solo la microbiota intestinal influye en la conducta individual y social, sino que también estas conductas pueden configurar la composición de la microbiota.
Eje cerebro-intestino-microbiota y estrés fisiológico y psicológico
La inadecuada respuesta de un individuo a las situaciones de estrés con las que tiene que enfrentarse supone un desajuste de la comunicación neuroinmunoendocrina, lo que conlleva un importante riesgo de morbilidad. Estas situaciones de estrés se asocian con el aumento de estrés oxidativo e inflamatorio general, incluyendo intestino y cerebro) que se encuentran en la base de la mayor presencia de enfermedades y de la aceleración del proceso de envejecimiento. Como es sabido, en respuesta a situaciones de estrés, se establece una respuesta a través del eje simpático-adreno-medular (SAM) y del eje neuroendocrino hipotálamo-hipófisis-adrenal (HHA). En el estrés psicológico y psicosocial se encuentra más implicado el eje HHA y la consecuente producción de glucocorticoides, como el cortisol. Dado el carácter de cronicidad que tienen estos tipos de estrés, el eje HHA se encuentra desregulado, lo que supone un importante riesgo de enfermedades mentales, como se ha comprobado para la ansiedad y depresión. La microbiota intestinal permite una buena regulación de este eje HHA (de hecho, animales libres de gérmenes presentan una respuesta exagerada del eje a las situaciones de estrés), pero también del control que el nervio vago (la auténtica autopista de comunicación entre microbiota y cerebro) tiene sobre dicho eje HHA.
El eje microbiota-intestino-cerebro en la salud y la enfermedad
En los últimos años se ha comprobado cómo las alteraciones en la microbiota intestinal (la disbiosis) pueden estar en la base de cientos de enfermedades, las cuales no se circunscriben únicamente al ámbito digestivo, sino que afectan a todos los órganos y sistemas. Estas patologías suelen tener como base el inadecuado funcionamiento de los sistemas homeostáticos. En muchas de ellas se aprecia claramente que el sistema inmunitario está siendo el principal afectado (son las alergias, enfermedades autoinmunes, cánceres, etc.), pero en otras lo es el sistema endocrino (diabetes, obesidad, etc.) y en otras el sistema nervioso. Sobre este último caso, hay un gran abanico de enfermedades mentales en las que se ha detectado la incidencia de la microbiota. En muchas enfermedades psiquiátricas, como la ansiedad y la depresión (las más estudiadas en este contexto), la microbiota intestinal parece tener un papel importante en su etiología. Pero también esa microbiota es un importante factor de riesgo en la esquizofrenia, el trastorno bipolar, el autismo, e incluso en las enfermedades neurodegenerativas como el Parkinson o el Alzheimer. En un post reciente ya comentamos la presentación del Documento de Consenso realizado por tres destacadas sociedades científicas sobre la microbiota y el uso de probióticos/prebióticos en patologías neurológicas y psiquiátricas
Una pregunta que se ha planteado frecuentemente es cuál de esos dos hechos es causa o consecuencia, la disbiosis o la patología. No se tiene una respuesta clara; puede que la disbiosis, muy fácilmente generada por toda una serie de factores que pueden incidir en esa microbiota intestinal y que se comentarán seguidamente, sea la causa de la patología, o también es posible que la enfermedad repercuta dando una microbiota alterada. Algunos datos experimentales apuntan a la gran relevancia de la microbiota en la aparición y/o sintomatología de las patologías. Por poner un ejemplo, se ha comprobado que en un modelo de Parkinson en ratón, con todos los síntomas de la enfermedad, los mismos desaparecen al quitar la microbiota intestinal, pero vuelven a aparecer cuando se hace un trasplante de individuos con Parkinson.
Factores que inciden en el eje microbiota-intestino-cerebro
Es sabido que el adecuado funcionamiento de los sistemas homeostáticos, y por tanto el estado de salud, va a depender de los genes que tenga cada individuo, pero de manera fundamental va a ser el ambiente y el estilo de vida lo que se encuentra más implicado en ese funcionamiento. Por ello, la incidencia de esos factores, muy relevante en los primeros momentos de la vida, va a tener una repercusión importante en la capacidad del individuo para mantener su salud o, por el contrario, para presentar un alto riesgo de morbilidad.
Numerosos factores, entre los que se puede destacar de forma importante la dieta, pero también la actividad física, las relaciones sociales, los contactos con el ambiente, el ritmo circadiano, la exposición a medicamentos, especialmente antibióticos, el descanso, la emocionalidad que se tenga, o el control del estrés, entre otros, van a condicionar el estado de la microbiota, el de los sistemas homeostáticos, así como el dialogo que establecen, incidiendo, por tanto, en el eje microbiota-intestino cerebro.
Uno de los mecanismos de actuación de los factores mencionados que inciden en el eje microbiota-intestino-cerebro se lleva a cabo modulando el estrés oxidativo e inflamatorio de los sistemas homeostáticos, el cual va a estar en la base del buen o mal funcionamiento de los mismos. Un elevado estrés oxidativo e inflamatorio va a suponer un deterioro homeostático y un riesgo de mayor morbilidad. Una situación de disbiosis se asocia con mayor presencia de microorganismos que favorecen esa oxidación-inflamación, que va a detectarse no solo en el intestino, sino también en el cerebro y en todo el organismo. Un ejemplo es la mayor presencia de especies productoras de lipopolisacáridos que pueden llegar al cerebro por vía sanguínea o nerviosa y, activando la microglía para producir citoquinas proinflamatorias y oxidantes, y generar neuroinflamación y estrés oxidativo. Sin embargo, una microbiota con componentes productores de adecuados metabolitos, como los AGCC, especialmente el butirato, permite disminuir esa oxidación e inflamación.
Los probióticos en el eje microbiota-intestino-cerebro
Los probióticos han demostrado poder tener un papel importante en el mantenimiento de la salud, lo cual pueden conseguir a través de su incidencia mejorando los diferentes componentes del eje microbiota-intestino-cerebro. Los probióticos pueden normalizar una microbiota alterada, pero también tienen una acción directa en los sistemas homeostáticos. Así, tanto los denominados “inmunobióticos”, al permitir mejorar el funcionamiento del sistema inmunitario, como los “psicobióticos”, al hacerlo en el sistema nervioso y, por tanto, mejorar la salud mental, pueden conseguir esa mejor homeostasis general y, consecuentemente, alcanzar un estado saludable. Además, al favorecer el mantenimiento de la salud, pueden incidir en el envejecimiento y permitir una mayor esperanza de vida, hecho que se ha observado en animales de experimentación, y que se ha comprobado que llevan a cabo controlando el estrés oxidativo-inflamatorio que subyace en la mayor velocidad a la que se envejece. Estos hechos han puesto de relevancia a los recientemente denominados “gerobióticos”, los cuales podrían permitir una mayor longevidad saludable.
Conclusiones
El denominado eje microbiota-intestino-cerebro, basado en la adecuada comunicación entre la microbiota intestinal y los sistemas homeostáticos de esta localización y la correcta llegada de todos los mediadores generados en la misma al cerebro, pero también al resto del organismo, resulta fundamental para el mantenimiento de la salud. Dado que en la conformación, desarrollo y funcionalidad de los constituyentes de este eje intervienen los genes que tenga cada persona, pero fundamentalmente los factores del ambiente y de estilo de vida a lo largo de toda la existencia, es entendible que este eje será diferencial para cada individuo. Así, se puede decir que cada uno de nosotros tiene su propia microbiotabiografía, lo mismo que su psiconeuroinmunobiografía, lo que dará unos ejes microbiota-intestino-cerebro característicos. La utilización de cepas probióticas que mejoren los sistemas homeostáticos permitirá un adecuado mantenimiento de la salud, retrasando la aparición de patologías y propiciando una mayor longevidad.
Bibliografía
- Arboleya S. Cambios a lo largo de la vida en el eje microbiota-intestino-cerebro. Factores que inciden en el eje. En: Documento de Consenso sobre la Microbiota y el uso de Probióticos/Prebióticos en Patologías Neurológicas y Psiquiátricas. Madrid: Neuraxpharm, 2021; 76-91.
- Barbosa RSD, Vieira-Coelho MA. Probiotics and prebiotics: focus on psychiatric disorders-a systematic review. Nutr Rev. 2020; 78: 437-50.
- Champagne-Jorgensen K, McVey-Neufeld KA. The effect of microbiota on behavior. Mod Trend Psychiatry. 2021; 32: 58-67.
- Constante M, De Palma G, Lu J, Jury J, Rondeau L, Caminero et al. Saccharomyces boulardii CNCM I-745 modulates the microbiota-gut-brain axis in a humanized mouse of irritable bowel syndrome. Neurogastroenterology & Motility. 2020; 00: e13985.
- De la Fuente M. Bio-psycho-social bridge: the psychoneuroimmune system in successful aging. In: Fernández-Ballesteros R, Benetos A, Robine JM (Eds.). Cambridge Handbook of Succesful Aging. New York: Cambridge University Press, 2018; 265-80.
- De la Fuente M. Oxidation and inflammation in the immune and nervous systems, a link between aging and anxiety. In: Fulop T, Franceschi C, Hirokawa K, Pawelec G (eds.). Handbook of Immunosenescence. Springer Nature, 2018; 1-31.
- De la Fuente M. La Psiconeuroinmunología. En: Marcos A (Ed). Inmunonutrición. Estilo de vida. Madrid: Editorial Médica Panamericana, 2019; 47-68.
- De la Fuente M. Interactions between the gut microbiota and the nervous system. Microbiota-gut-brain axis in health and mental disease. Approach Aging Control. 2020; 24: 65-81.
- De la Fuente M. The role of the microbiota-gut-brain axis in the health and illness condition: A focus on Alzheimer´s disease. J Alzheimers Dis. 2021; 81 (4): 1345-60.
- De la Fuente M, Martín Villa JM. Psiconeuroinmunoendocrinología y eje microbiota-intestino-cerebro. En: Documento de Consenso sobre la Microbiota y el uso de Probióticos/Prebióticos en Patologías Neurológicas y Psiquiátricas. Madrid: Neuraxpharm, 2021; 61-75.
- Fung TC. The microbiota-immune axis as a central mediator of gut-brain communication. Neurobiol Dis. 2020; 136: 104714.
- Generoso JS, Giridharan VV, Lee J, Macedo D, Barichello T. The role of the microbiota-gut-brain axis in neurosychiatric disorders. Braz J Psychiatry. 2021; 43: 293-305.
- Gubert C, Kong G, Renoir T, Hannan AJ. Exercise, diet and stress as modulators of gut microbiota: implications for neurodegenerative diseases. Neurobiol Dis. 2020; 134: 104621.
- Juarez I, Vaquero-Yuste Ch, Martin-Villa JM. Microbiota and immune system. Approach Aging Control. 2020; 24: 48-64.
- Labanski A, Langhorst J, Engler H, Elsenbruch S. Stress and the brain-gut axis in functional and chronic-inflammatory gastrointestinal diseases: a transdiciplinary challenge. Psychoneuroendocrinology. 2020; 111: 104501.
- Murakami M, Tognini P. The circadian clock as an essential molecular link between host physiology and microorganisms. Front Cell Infect Microbiol. 2020; 9: 469-79.
- Spichak S, Bastiaanseen TFS, Berding K, et al. Mining microbes for mental health: determining the role of microbial metabolic pathways in human brain health and disease. Neurosc Behav Rew. 2021; 125: 698-761.
- Tsai Y-Ch, Cheng L-H, Liu Y-W, Jeng O-J, Lee Y-K. Gerobiotics: probiotics targeting fundamental aging processes. Biosc Microb Food Health. 2021; 40: 1-11.
- Ud Din A, Mazhar M, Waseem M, et al. SARS-Cov-2 microbiome dysbiosis linked disorders and possible probiotics role. Biomed Pharmacother. 2021; 133: 110947.
- Wilmes L, Collins JM, O´Riordan KJ, O´Mahony SM, Cryan JF, Clarke G. Of bowels, brain and behavior: a role for the gut microbiota in psychiatric comorbidities in irritable bowel syndrome. Neurogastroenterology & Motility. 2021; 33: e14095.