La cohorte TEDDY es un estudio observacional prospectivo que, desde 2003 hasta 2010, incluyó a más de 8.000 recién nacidos con el fin de identificar factores ambientales que favorecen o, por el contrario, previenen la aparición de autoinmunidad (autoanticuerpos) y el desarrollo eventual de diabetes mellitus tipo 1.
La diabetes mellitus tipo 1 (DM1) es una enfermedad autoinmune caracterizada por el rechazo inmunológico y la destrucción selectiva de las células beta productoras de insulina en el páncreas endocrino, causando deficiencia absoluta y permanente de insulina. Suele manifestarse clínicamente en las primeras dos décadas de la vida, generalmente antes de los 30 años, pero pueden detectarse autoanticuerpos (anticuerpos antiinsulina –IAA–, antidecarboxilasa del ácido glutámico –GADA–, y antitirosina fosfatasa de membrana –IA-2–) desde el primer año de vida. La susceptibilidad para contraer la enfermedad está asociada a factores genéticos, especialmente a alelos específicos HLA-DR3 y DR4 del complejo mayor de histocompatibilidad, aunque solo el 15-20% de los pacientes tienen historia familiar. Los factores ambientales juegan un papel crítico, ya que los genotipos de susceptibilidad HLA-D3 y D4 están presentes en el 40% de la población pero menos del 1% desarrollan la enfermedad. Además, la incidencia de DM1 está aumentando rápidamente en niños y adolescentes, con incremento anual del 3-4%1, patrón epidemiológico incompatible con pura herencia genética.
La cohorte TEDDY es un estudio observacional prospectivo que, desde 2003 hasta 2010, incluyó a más de 8.000 recién nacidos con alelos HLA de susceptibilidad (7.748 bebés) o antecedentes familiares de primer grado (928 bebés) en centros de Estados Unidos, Alemania, Suecia y Finlandia1. El objetivo principal del estudio es identificar factores ambientales que favorecen o, por el contrario, previenen la aparición de autoinmunidad (autoanticuerpos) y el desarrollo eventual de DM1. Recientemente, TEDDY ha reportado1 que a los 10 años de edad la incidencia acumulada de aparición de al menos un autoanticuerpo (seroconversión a IAA, GADA o IA2 positivo) en la cohorte es del 12,2%, y la de 2 o 3 autoanticuerpos es del 7,1%. Cinco años después de la seroconversión, el 47% de los niños con tres autoanticuerpos desarrollaron DM1, pero solamente el 11% de los niños con un solo autoanticuerpo. La aparición de autoanticuerpos es más frecuente en los primeros cuatro años de vida.
El estudio ha detectado que las infecciones respiratorias, pero no las gastrointestinales, se asocian temporalmente con aparición de autoanticuerpos, y por tanto se confirma que incrementan el riesgo de DM11. Sin embargo, el uso de antibióticos no parece incrementar el riesgo2, en contra de lo sugerido por estudios experimentales3.
En mi opinión, los datos más novedosos de TEDDY hasta la fecha se han obtenido del análisis de microbiota fecal en un subgrupo de 900 niños, en los que se observó que la abundancia de Lactobacillus rhamnosus en muestras obtenidas durante el primer año de vida era significativamente menor en los niños que posteriormente desarrollaron autoinmunidad4 (figura 1). Este hallazgo motivó un análisis en toda la cohorte que demuestra que los bebés que recibieron probióticos durante el primer mes de vida tienen significativamente menos riesgo de desarrollar autoinmunidad que los que no recibieron probióticos durante su primer año de vida5. En bebés con genotipos HLA DR y D4, los probióticos redujeron el riesgo de autoinmunidad en un 60%. El análisis no discrimina entre probióticos y es válido para la aparición de autoanticuerpos durante los primeros 9 años de vida (figura 2).
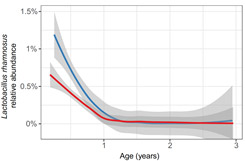
Figura 1. La abundancia de Lactobacillus rhamnosus en muestras obtenidas durante el primer año de vida era significativamente menor en los niños que posteriormente desarrollaron autoinmunidad.
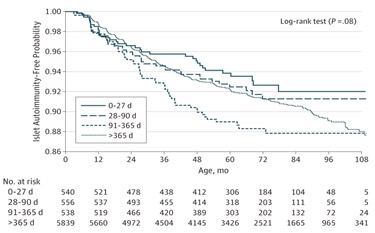
Figura 2. En bebés con genotipos HLA DR y D4, los probióticos redujeron el riesgo de autoinmunidad en un 60%.
Los estudios observacionales tienen la ventaja de mostrar lo que ocurre en la vida real y la desventaja de que no son sólidos para demostrar causalidad, por los múltiples factores que pueden intervenir en el fenómeno observado. En cualquier caso, se trata de un hallazgo muy novedoso y posiblemente de gran trascendencia. El intestino del bebé, en su primer mes de vida, es aún inmaduro y permeable, y los probióticos podrían evitar el paso de macromoléculas que desencadenarían los procesos de autoinmunidad.
Bibliografía
- Rewers M, Hyöty H, Lernmark Å, et al. The Environmental Determinants of Diabetes in the Young (TEDDY) Study: 2018 Update. Curr Diab Rep. 2018; 18(12): 136.
- Kemppainen KM, Vehik K, Lynch KF, et al. Association Between Early-Life Antibiotic Use and the Risk of Islet or Celiac Disease Autoimmunity. JAMA Pediatr. 2017; 171(12): 1217-25.
- Livanos AE, Greiner TU, Vangay P, et al. Antibiotic-mediated gut microbiome perturbation accelerates development of type 1 diabetes in mice. Nat Microbiol. 2016; 1(11): 16140.
- Vatanen T, Franzosa EA, Schwager R, et al. The human gut microbiome in early-onset type 1 diabetes from the TEDDY study. Nature. 2018; 562(7728): 589-94.
- Uusitalo U, Liu X, Yang J, et al. Association of Early Exposure of Probiotics and Islet Autoimmunity in the TEDDY Study. JAMA Pediatr. 2016; 170(1): 20-8.




Excelente análisis. El papel de la microbiota en la enfermedades de curso crónico como diabetes y cáncer es un nicho fértil para la.investigacion. Recobra valor la conducta alimentaria y la calidad de la alimentación cada vez más