A partir de la experiencia positiva en situaciones relacionadas con la inmunosupresión, se ha comenzado a evaluar la utilidad de los probióticos en otros tipos de pacientes inmunosuprimidos, como aquellos que han recibido un trasplante de médula ósea.
El uso de probióticos en pacientes inmunodeprimidos ha sido objeto de un amplio debate desde hace muchos años. Debido a esto, es conveniente moverse en terreno firme al acercarse a esta cuestión. Al evaluar los estudios existentes a la fecha, lo más apropiado es definir con precisión a qué tipo de inmunosupresión y qué tipo de probiótico se está haciendo referencia en cada caso. ¿Es el mismo tipo de paciente aquel cuya inmunidad se ve afectada por una enfermedad neoplásica, por malnutrición o por un proceso primario, que aquel que se encuentra bajo una inmunosupresión como parte de un tratamiento, o previo a un trasplante? Sin duda, no estamos hablando de pacientes similares. Por otro lado, ¿existe el mismo riesgo al administrar un probiótico aislado, comensal habitual de un sujeto, que una mezcla de cepas bacterianas novedosas para el paciente? También en este caso es imprescindible establecer una diferencia.
Dicho esto, es conveniente repasar en qué situación nos encontramos hoy en cuanto a la posibilidad de mejorar la calidad de tratamiento de pacientes que, en teoría, podrían beneficiarse notablemente de una flora intestinal sana.
Diversos estudios han corroborado los beneficios del uso de probióticos (aislados o en forma de mezcla de diferentes organismos) en pacientes portadores de enfermedades inflamatorias intestinales (EII), como la enfermedad de Crohn (EC) o la colitis ulcerosa (CU)1. Es sabido que la mayoría de los pacientes que sufren estas enfermedades presentan dos características que podrían dificultar el uso de comensales de la flora intestinal:
- Se encuentran bajo tratamiento farmacológico habitualmente inmunosupresor, presentando mayor riesgo de infecciones diseminadas.
- Presentan lesiones de la mucosa intestinal, presentando mayor riesgo de traslocación y sepsis.
Sin embargo, los estudios han demostrado una elevada seguridad durante el uso de probióticos seleccionados2. Los escasos eventos adversos se han relacionado a la forma de administración de los organismos, por ejemplo, a enemas o biopsias llevados a cabo durante el trasplante de materia fecal (TMF)3.
A partir de esta experiencia positiva, se ha comenzado a evaluar la utilidad de los probióticos en otro tipo de pacientes inmunosuprimidos: los trasplantados de médula ósea (TMO). Dado que hay creciente evidencia de que la disbiosis de la microbiota intestinal es responsable de la producción de complicaciones postrasplante, no sería erróneo pensar que el mantenimiento de una microflora intestinal sana podría mejorar la morbilidad y mortalidad asociadas a estos procedimientos.
La pérdida de diversidad microbiana y de flora comensal resulta en un sobrecrecimiento de organismos patológicos, aumentando el riesgo de sepsis por gérmenes resistentes. Al igual que en las EII, la acción probiótica habitual (remodelación de la flora, supresión directa de ciertos patógenos, regulación de la respuesta inmune por estímulo de citoquinas e IgA, y conservación de la función de barrera intestinal) beneficiaría al paciente, eliminando la disbiosis y disminuyendo los síntomas habituales postrasplante:
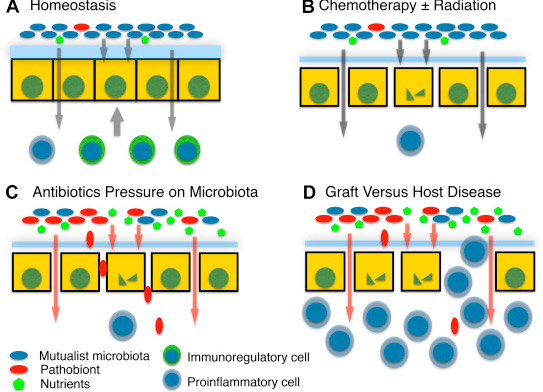
4
Imaginemos entonces a un paciente cuya inmunosupresión es grave, que ha sido sometido a un procedimiento de alto riesgo, y cuya microbiota sana puede conducirlo a una menor tasa de diarrea, de enfermedad del injerto contra el huésped (EICH)5 y de infecciones graves postrasplante. Sin duda, estamos parados al inicio de un camino que parece promisorio: deberíamos empezar a andarlo.
Bibliografía
1. Andermann TM, Rezvani A, Bhatt AS. Microbiota manipulation with prebiotics and probiotics in patients undergoing stem cell transplantation. Curr Hematol Malig Rep. 2016; 11(1): 19-28.
2. Ladas EJ, Bhatia M, Chen L et al. the safety and feasibility of probiotics in children and adolescents undergoing hematopoietic cell transplantation. J Bone Marrow Transplant. 2016; 51: 262-66.
3. Baxter M, Colville A. Adverse events in faecal microbiota transplant: a review of the literature. J Hosp Infect. 2016; 92: 117-27.
4. Khoruts A, Hippen KL et al. Toward revision of antimicrobial therapies in hematopoietic stem cell transplantation: target the pathogens, but protect the indigenous microbiota. Translat Res. 2017; 179: 116-25.
5. Yoshioka K, Kakihana K, Doki N, Ohashi K. Gut microbiota and acute graft-versus-host disease. Pharmacol Res. 2017; 122: 90-5.
6. Raghunathan VM, Sheng I, Lim SH. Intestinal dysbiosis and allogeneic hematopoietic progenitor cell transplantation. J Transl Med. 2016; 14: 335-40.



